Axel Pruss a*, Moujahed Kao b, Thomas von Garrel c, Lars Frommelt d, Lutz Gurtler e, Frank Benedix a, Georg Pauli b
a Institute for Transfusion Medicine (Tissue Bank), University Hospital Charite ́, CCM, Schumannstrasse 20/21, 10117 Berlin, Germany
b Robert Koch-Institut, Retrovirology, Berlin, Germany
c Clinic for Traumatology, Philipps University, Marburg, Germany
d Institute for Infectiology, Clinical Microbiology and Hospital Hygiene, ENDO-Clinic, Hamburg, Germany
e Friedrich Loeffler Institute for Medical Microbiology, Ernst Moritz Arndt University, Greifswald, Germany
Received 10 September 2002; accepted 15 October 2002
Резюме
Несколько процедур инактивации вирусов, такие как термообработка, гамма-облучение и химическая стерилизация используются для повышения безопасности при трансплантации костной ткани. В этом исследовании мы представляем данные по инактивации вирусов посредством тепловой дезинфекции бедренных головок человека, используя Марбургскую систему костного банка "Lobator s d-2". Были исследованы три оболочечных вирусов (вирус иммунодефицита человека типа 2 [H IV-2], вирус бычей диареи в качестве модели для вируса гепатита С [H CV], и вирус герпеса псевдобешенства), и три безоболочечных вирусов (вирус гепатита А, вирус полиомиелита и бычий парвовирус).
В модельной системе центральная часть головки бедра человека была контаминирована соответствующей бесклеточной суспензией вируса, посредством прямого контакта между вирусом и нативной костной тканью. Температура ядра в головки бедра во время процесса стерилизации была определена в дополнительных модельных экспериментах. Температуру 82,5 С, указанную изготовителем в качестве температуры эффективной инактивации вирусов, поддерживали в течение, по крайней мере 15 минут в очищенных от хряща бедренных головок с диаметром 56 мм. Термическая обработка с помощью Lobator SD-2 обеспечивала инактивацию всех вирусов в головках бедренных костей человека ниже предела обнаружения (по крайней мере, на R4 log10). Высокий уровень безопасности может быть достигнут путем совмещения тщательного отбора доноров и серологического определения соответствующих маркеров инфекций (anti-HIV-1/2, HBsAg, anti-HBcore, anti-HCV, TPHA) с термообработкой бедренной головы в Lobator SD-2. Для дальнейшего повышения вирусной безопасности при трупных трансплантаций кости, рекомендуется проводить проверку полиорганных доноров ДНК- тестированием (т.е. ПЦР) на ВИЧ-инфекцию, гепатиты В и С (HIV, HBV и HCV).
2003 The International Association for Biologicals. Published by Elsevier Science Ltd. All rights reserved.
Keywords: Bone tissue transplants; Transplantation safety; Virus inactivation; Thermal disinfection; Lobator system
1. Введение
Несмотря на активизацию усилий по разработке альтернативных материалов и процедур, аллогенная трансплантация кости остается незаменимым инструментом для восстановления обширных костных дефектов. В частности трансплантация кости используется в хирургии для замены эндопротеза в тазобедренном суставе, при операциях на позвоночнике и реконструкции после обширных резекций опухоли.
В Германии ежегодно выполняется 71 000 аутологичных и 25 000 аллогенных трансплантаций костей ежегодно с дополнительной потребностью в примерно 18000 трансплантациях [1]. В США число имплантированных аллогенных трансплантатов костного исчисляется 300000 - 400000 в год [2].
В дополнение к клиническим или функциональным аспектам, риск передачи патогенов с помощью трансплантации вызывает большую озабоченность [3,4]. О передаче вирусов и патогенных микроорганизмо в костной тканью сообщалось в источниках[5,6]. Тем не
менее, отсутствие сообщений о передаче агентов, вызывающих трансмиссивные губчатые энцефалопатии ТГЭ, такие как болезнь Крейтцфельда-Якоба, при аллогенных трансплантациях кости, подразумевает, крайне низкий риск передачи ТГЭ агентов костной тканью [7].
В качестве исходного материала для производства костных трансплантатов используются кости конечностей, такие как головка бедренной кости и большой берцовой кости, позвонки и подвздошная кость. Головки бедренных костей особенно хорошо подходят для коррекции неправильного положения, а также для индивидуальной адаптации трансплантатов при эндопротезировании, потому что они могут быть точно подобраны по размеру и форме, обеспечивая прочность соединения.
Для гарантии отсутствия патогена в ткани должны быть соблюдены специальные требования. В дополнение к их неизменной эффективности, центральным вопросом в оценке качества должна быть валидация дезинфекции или стерилизации тканей.
В соответствии с руководящими принципами управления костными банками немецкий медицинской ассоциации, только подвергнутые иннактивации аллогенные кости или костные материалы, могут быть использованы для трансплантации в тех случаях, когда имеет место невозможность тестирование донора после достаточно долгого карантина [8].
В настоящее время в производстве трансплантатов костной ткани используются такие методы инактивации вирусов как термообработка [9,10], гамма-облучение [11,12], обработка надуксусной кислотой и этанолом [13-15]. В Германии распространенным методом является термообработка головки бедра в системе Lobator sd-2 (телос, Марбург, Германия). В отличие от других методов снижения патогенов, теплофизическая дезинфекция сохраняет надлежащие биологические свойства кости [10,16]. Хотя предыдущие валидационные исследования показали
соответствие процедуры требованиям национальных и международных стандартов [10,17-21], систематических исследований дезинфекции системой Lobator sd-2 было проведено не достаточно.
Целью этого исследования была проверка вирус-инактивации системой Lobator sd-2 контаминированных вирусом головок бедренных костей человека. Мы разработали модель системы для проверки процедуры инактивации, имитируя условия in vivo. Центр головки бедра человека был контаминирован высоким титром безклеточной вирусной суспензии, создавая прямой контакт вируса и кости. Это представляет особый интерес, так как в предыдущих исследованиях ПЦР пробирки, содержащие вирусную суспензию были помещены в центр головки бедренной кости. В такой модели системы не представляется возможным определить влияние компонентов крови и костей на устойчивость вируса [22].
2. Материалы и методы
2.1. Вирусы
Выбор вирусов производился в соответствии с рекомендациями Института Пауля Эрлиха и Федерального института лекарственных средств и изделий медицинского назначения (Paul-Ehrlich-Institut и Bundesinstitut fu ̈r Arzneimittel und Medizinprodukte) [17]. Использовались следующие вирусы:
2.1.1. Оболочечные вирусы
Вирус иммунодефицита человека типа 2 (H IV-2), ssRNA, Retroviridae, изолированные SBL6669 - перевиваемые суспензионные клеточные линии Molt 4 clone 8 cells. Этот вирус является моделью для ВИЧ-1. Он классифицируется как имеющий низкую резистентность к физико-химической обработки и инактивируется при 60 С [19,20,22].
Вирус бычьей вирусной диареи (BVDV), ssRNA, Flaviviridae, штамм Ug 59/Дания, как модели вируса гепатита для C вируса (HCV)-BVDV выращивали в эмбриональной телячей клетке. BVDV и HCV оба принадлежат к семейству Flaviviridae и имеют сопоставимые физико-химические свойства (данные Центральной лаборатории Нидерландов, службы переливания крови Департамента клинической Виро-Иммунологии [CLB] и Ref. [19]).
Вирус Pseudorabies (PRV; вирус болезни Ауески свиней), двухцепочечная ДНК герпесвирусов, штамм Барта выращенная в клетках легкого норки. PRV используется в качестве модели для человека вирусов герпеса. Он считается умеренно устойчивым к термической обработке [19].
2.1.2. Безоболочечные вирусы
Вирус гепатита А (ВГА), ssRNA, Picornaviridae, штамм HM-175cyt выращенных в эмбриональных клетках почек макак, CRL 1688. ВГА считается высоко устойчивым к термообработке [19].
Вирус полиомиелита типа 1 (PV-1), ssRNA, Picornaviridae, вакцинный штамм PI-18 выращивали в клетках легких человека. PV-1 считается умеренно устойчивым к термической обработке [19]. Через 30 мин при 60 С наблюдалась полная инактивация[22].
Бычий парвовирус (BPV), ssДНК, Parvoviridae-BPV небольшой вирус (около 20 нм) с икосаэдриальной симметрией. может быть выращен в клетках легких теленка и широко принят в качестве модели для человеческого парвовируса В19 из-за его очень высокой устойчивости к нагреву (данные CLB, Реф. лаборатории Нидерланды. [19]).
2.2. Культивирования клеток и титрование вирусов
Культивирования клеток, а также титрование вирусов проводили в ламинарном боксе, как описано ранее [13,23].
2.3. Костный материал (головки бедренных костей)
При подготовка головок бедра, используемых в настоящих исследований следовали процедурам, обычно используемым в костном банке Университетской клиники Charite' (Берлин, Германия). Костные доноры были отрицательными на ВИЧ-1/2 (HIV-1/2), HCV, HBsAg и TPHA при серологическом тестировании. Головки бедренных костей, с диамертов, как правило, 55 +/- 1 мм хранили при 70 С до использования.
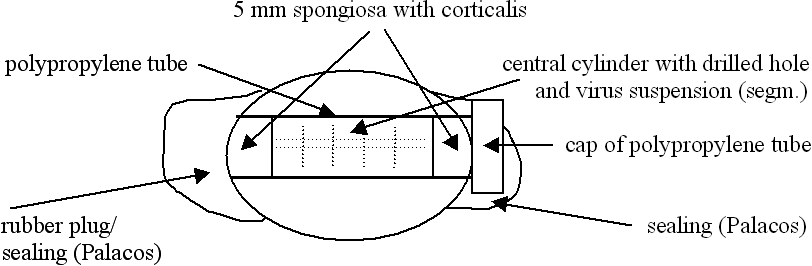
Fig. 1. Схематическое изображение головки бедренной кости, подготовленный для исследования.
Человеческие головки бедренных костей были извлечены из морозильной камеры (-70 с) и оттаивали в бидистиллированной воде при 20 ° С (ткань была проверена на наличие видимых повреждений, в особенности некрозов). Интактная ткань был была освобождены от хряща, т.е. хрящ вручную был удален при помощи скальпеля и рашпиля или фрезерного резака (Aesculap, Туттлинген, Германия). Чтобы подготовить костную ткань , она была обработан, как показано схематически на рис. 1.
Через центр головки человеческой бедренной кости освобожденной от хряща, начиная с сагиттальной плоскости, был выпилен костный цилиндр (диаметром 15 мм) при помощью лобзика при постоянном охлаждении. Полученный сквозной канал головки бедренной кости был расширен до диаметра 17 мм, чтобы вмещать 15-мл полипропиленовую центрифужную пробирку с внешним диаметром 17 мм и внутренним диаметром 15мм (Nunc, Wiesbaden, Германия). Нижняя часть 120 мм длинной трубке была отрезана, чтобы соответствовать длине канала. На одном конце цилиндра был выпилен 5мм диск для использования в дальнейшем в качестве крышки. В оставшемся цилиндре было пробурено центральное отверстие длиной 45мм (диаметр 6мм), с сохранением нижней плоскости в 5мм. Скважина служила контейнером для вирусных суспензий. В технических целях, для дальнейшей обработки в Omni-смесителе (типа ОМ, Ivan Sorvall Inc., Norwalk, CT), костный цилиндр был нарезан на 5 мм диски.
Открытый нижний конец трубки из полипропилена плотно закрыли резиновой пробкой, которая была герметичнаи зацементирована Palacos-R цементом (Heraeus Kulzer, Верхайм, Германия). Затем непросверленную часть костного цилиндра и просверленные цилиндрические диски помещали в трубку. После того, как скважина была заполнена 1 мл соответствующей вирусной суспензии, её закрыли костной крышкой. Затем крышку навинчивали на трубу. Подготовленная таким образом головка бедренной кости была помещена в стерильный контейнер в Lobator SD-2 и термически обработана в соответствии с инструкциями изготовителя (см ниже) в растворе Рингера (B. Braun Melsungen, Германия).
После стадии охлаждения вирус суспензию собирали из высверленного отверстии в стерильных условиях и определяли титр вируса.

Fig. 2. Marburg bone bank system Lobator sd-2.
Центральный цилиндр кости, а также суспензия, оставшееся в трубке были собраны, затем к ним добавили 9 мл клеточной культуральной среды и гомогенизировали кость в среде в стерильном контейнере из нержавеющей стали Omni-смесителя на ледяной бане при 1500 об/мин.
После центрифугирования смеси (4 (C, 3 000 g ) титры вирусов были определены в надосадочной жидкости, а также в суспензии из кости.
2.4. Система Lobator sd-2
Это устройство было разработано фирмой телос Н + V GmbH, Марбург, Германия, для термической дезинфекции аллогенных бедренных головок для внутреннего использования в клиниках (см. 2).
Температурные градиенты (фаза нагрева, плато, фаза охлаждения) в устройстве запрограммированы производителем и не могут быть изменены пользователем. По словам производителя, в центре головки бедра с диаметром 56 мм достигается температура 82,5 С в течение не менее 15 мин. Технических детали калибровки и проверки устройства, см. в документации производителя (http://www.telos1.de).
2.5. Оценка температурной кинетики путем определения внутренней температуры в головке бедра
Чтобы убедиться, что были достигнуты требуемая температура ядра и время проведения, были проделаны три дополнительных эксперимента на моделях: нативных головках бедренных костей (I), головках бедренных костей без хряща (II), и модель системы для проверки инактивации вирусов (III; см Таблица 3).
Сначала в связке головки бедренной кости (нативной или с удаленным хрящем) был пробурен канал диаметром 0,5 мм, заканчивающийся в центре головки бедренной кости (т.е. для головки бедренной кости размером 55 мм Ø: 0.5 27.5 мм).
Table 1. Определение температурной кинетики в головке бедра
| Диаметр головки (mm) |
Длительность инкубации
при ≥ 82.5 °C (min)
|
Пиковая температура (°C) |
Время достижения температуры 82.5 °C (min) |
| I: native | |||
| 52 | 26 | 85.7 | 53 |
| 53 | 20 | 84.7 | 54 |
| 61 | -a | 81.9a | -a |
| II: decartilaged | |||
| 51 | 31 | 88.3 | 48 |
| 52 | 32 | 86.2 | 49 |
| 53 | 29 | 87.2 | 46 |
| 53 | 24 | 85.7 | 53 |
| 54 | 21 | 84.7 | 53 |
| 54 | 23 | 84.6 | 54 |
| 56 | 24 | 85.3 | 50 |
| 61 | 15 | 83.8 | 64 |
| III: model system | |||
| 51 | 23 | 85.3 | 57 |
| 53 | 21 | 84.7 | 55 |
| 53 | 19 | 84.2 | 56 |
| 55 | 28 | 85.9 | 50 |
| 56 | 20 | 83.8 | 59 |
| 58 | 18 | 85.4 | 56 |
| 61 | 10 | 82.8 | 61 |
На его конце был установлен температурный датчик, позволяющий записывать только центральную температуру (T430-2L050, измерения от 40 до +500 °C, разрешение/точность 0.5 K; Therm 2281-8, Ahlborn Mess- und Regelungstechnik, Holzkirchen, Germany).
Датчик был установлен в кости в центральном положении (т.е. в примере, в положении 27,5 мм с Palacos-R костным цементом (Heraeus Kulzer).
Провод датчика температуры пропускали через винтовой колпачок дезинфекцинного контейнера. При проведеннии термообработки в полипропиленовый сосуде для дезинфекции следовали описанной методике обработки головки бедра. Температура фиксировалась через минуту и вручную заносилась в компьютерную программу (офф-лайн версия 4.32 / DOS, 7.10 DEMA-софт GmbH, Хольцкирхен, Германия).
3. Результаты
3.1. Измерение температуры в ядре
Начальная температура в головке бедренной кости колеблется от 24 до 26 °С. Это означает, что соответствующий диаметр, а также тип обработки играет определенную роль в кинетике температуры ядра при нагреве в устройстве (таблица 1). Кроме того, разница в теплопроводности отдельных костных тканей может повлиять на требуемое время нагрева и высоту пика температуры. Как и ожидалось, полипропиленовая трубка, вставляемая в костную ткань в модельной системе оказывала тормозящее влияние на кинетику , а также максимальную температуру в ядре головки.
Тем не менее, во всех экспериментах, оценивающих модель системы вируса (таблица 1, III) и головки бедренной кости (в диапазоне диаметров между 51 мм и 56 мм) температура ≥82.5 °C а также время инкубации, были достигнуты по крайней мере за 15 минут.
На рис. 3 приведена температурная кинетика в головках бедра диаметром 51, 53 и 56 мм, соответственно. Несмотря на более низкую начальную температуру, рост температуры в период нагрева в головки бедра был более крутым по сравнению с модельной системы. Кроме того, в нативных и очищенных от хряща бедренных головах пик температуры был выше и времени для нагрева до 82,5 °С потребовалось больше.
Анализ периода охлаждения показали, что снижение температуры в головки бедра происходило быстрее, чем в модельной системе (рис. 3). Однако, в общем температурная кинетика в головки бедра и в модельной системе были сопоставимы.
Для более точного сравнения температурной кинетики, были рассчитаны области ниже кривых, характеризующие относительное количество тепла. Площадь области между осями Х (время в мин.) и Y (температура в °C), характеризующие модельную систему и очищенную от хрящы головку бедра рассчитаны следующим образом:
Единица площади:
Unit of area= ( xi+1 - xi ) - ( ( yi+1 - yi ) / 2)
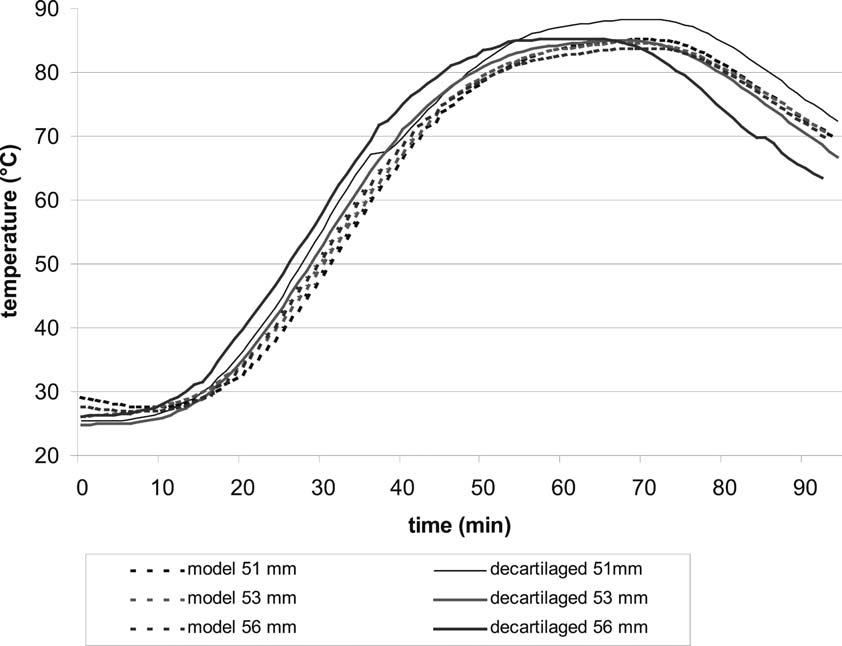
Fig. 3. Температурная кинетика (кривая) в головке
Таблица 2. Относительные величины тепла (температура/время в единицах площади) по отношению к диаметру головки бедренной кости
| Относительное количество тепла (в единицах площади) | Диаметр головки Ø (in mm) | ||
| 51 | 53 | 56 | |
|
Очищенная от хряща головка Модельная система |
6123.30 | 5901.95 | 5892.55 |
| 5842.55 | 5832.25 | 5750.65 | |
где xi - время в точке i and yi - температура в точке i.
Результаты, представленные в таблице 2, показывают, что в ходе процесса дезинфекции большее количество точек тепла в центре нативной очищенной от хряща головки бедренной кости, чем в центре модельной системы.
На рис. 3 интервал времени задается при температуре ≥82.5 °C (С по отношению к диаметру головки бедренной кости.
Производитель заявляет, что в этом интервале инактивация проходит эффективно. В модельной системе наблюдается более короткий интервал при температуре выше 82,5 по сравнению с нативной или очищенной от хряща головкой бедренной кости. Тем не менее, во всех нативных или очищенных от хряща головки бедра, а также моделях с диаметром до 58 мм была достигнута и сохраняется в течение необходимого время 15 мин требуемая температура 82,5. Исключением были модели головки бедренной кости с диаметром 61 мм, в которой поддерживалась только температура 82,5 в течение 10 мин и нативная головка бедренной кости, в которой была достигнута лишь пиковая температура 81,9 (таблица 1).
3.2. Инактивация вирусов
Для каждого эксперимента были подготовлены две головки бедренных костей с одинаковым диаметром (54-56 мм). Обе были контаминированы вирусной суспензией, одну головку подвергли дезинфекции в Lobator, а другую инкубировали при комнатной температуре (RT) и в 4 С, в качестве контроля для определения влияния костной ткани и условий хранения на инактивацию вирусов.
Три независимых эксперимента проводили для каждого вируса. В двух экспериментах инкубирование проводили при комнатной температуре 20-25 °С, (таблица 3). В третьем эксперименте инкубация проводилось при 4 С (таблица 4).
Исследования инактивации показали, что в устройстве все вирусы инактивируются ниже уровня обнаружения, т.е. применение программы Lobator SD-2 привело к снижению вирусной более чем на 4 log10 в ядре головки бедра человека. Контроль, инкубированный параллельно при комнатной температуре показал очень высокую спонтанную инактивацию, в частности, для ВИЧ-2. Когда контроль инкубировали при 4 ° С, наблюдали отсутствие или очень слабое влияние на титр вируса.
В некоторых экспериментах - вероятно, в зависимости от биологических и структурных свойств используемой головки бедренной кости, наблюдался токсический эффект на индикаторные клетки после инкубации в течение 94 мин в системе Lobator SD-2. Как показано в таблице 3, это привело к более высоким пределом обнаружения (TCID 50 given as log 10 ), т.е ≤2.49 (BPV, PRV, BVDV, HAV), соответственно.
Кроме того, в экспериментах по инактивации PV-1 суспензии, а также в гомогенатах костных цилиндров были обнаружено токсическое действие на клетки, и в этих суспензий титр вируса не мог быть определен (таблица 3). Ни в одной другом эксперименте в Lobator SD-2 токсический эффект не был обнаружен.
Table 3. Эксперименты по инактивации вирусов в установке Lobator sd-2 (Lsd-2) с контролем при комнатной температуре RT (значения приведены как log10)
| Вирус | Начальный титр (TCID50/ml) | Титр вируса 94 min/RT-комн темп (TCID50/ml) | Титр вируса 94 min/Lsd-2 (TCID50/ml) | Подавление вирусной активности Reduction factor 94 min/RT-комн. темп (TCID50/ml) | Reduction factor 94 min/Lsd-2 (TCID50/ml) |
| BPV | 8.49 | 4.74 |
≤2.49
|
3.75
|
≥6.00
|
| BPV | 8.25 | 5.74 |
≤2.49
|
2.51
|
≥5.76
|
| BPV | 7.49 | 3.74 |
≤1.49
|
3.75
|
≥6.00
|
| PRV | 8.00 | 4.49 |
≤2.49
|
3.51
|
≥5.51
|
| PRV | 8.37 | 6.25 | ≤1.49 |
2.12
|
≥6.88
|
| PV-1 | 10.38 | 7.87 | n.e.p. |
2.51
|
n.e.p.
|
| PV-1 | 9.87 | 7.37 | n.e.p. |
2.50
|
n.e.p.
|
| HIV-2 | 5.55 | ≤1.49 | ≤1.49 |
≥4.06
|
≥4.06
|
| HIV-2 | 5.00 | ≤1.49 | ≤1.49 |
≥3.51
|
≥3.51
|
| BVDV | 6.74 | 5.49 | ≤2.49 |
1.25
|
≥4.25
|
| BVDV | 6.62 | 5.25 | ≤2.49 |
1.37
|
≥4.13
|
| HAV | 7.40 | 4.88 | ≤1.49 |
2.52
|
≥5.91
|
| HAV | 6.50 | 5.50 |
≤2.49
|
1.00
|
≥4.01
|
| HAV | 7.90 | 6.50 | ≤2.49 | 1.40 | ≥5.41 |
n.e.p., невозможно оценить
TCID50/ml вычисляется по Spearman and K ̈arber [24].
Table 4. Эксперименты по инактивации вирусов в установке Lobator sd-2 (Lsd-2) с контролем при 4 °C (значения приведены как log10)
| Virus | Starting titer (TCID50/ml) | Virus titre 94 min/4 °C (TCID50/ml) | Virus titre 94 min/Lsd-2 (TCID50/ml) | Reduction factor 94 min/4 °C (TCID50/ml) | Reduction factor 94 min/Lsd-2 (TCID50/ml) |
|
BPV
|
5.75
|
6.00
|
≤1.49
|
None
|
≥4.26
|
|
HIV-2
|
7.00
|
5.75
|
≤1.49
|
1.25
|
≥5.51
|
|
PRV
|
8.50
|
7.50
|
≤1.49
|
1.00
|
≥7.01
|
|
PV-1
|
8.00
|
8.00
|
≤1.49
|
None
|
≥6.51
|
|
BVDV
|
6.00
|
6.25
|
≤1.49
|
None
|
≥4.51
|
| HAV | 8.00 | 7.49 | ≤1.49 | 0.51 | ≥6.51 |
Уровень обнаружения вируса был рассчитан как ниже чем ≤1.49 TCID50.
Принимая во внимание результаты, полученные в трех независимых экспериментах, можно сделать вывод, что температура инкубации (комнатная -RT по сравнению с 4 С оказывает существенное влияние на спонтанную потерю инфекционности. Кроме того, токсические эффекты, наблюдаемые на отдельных препаратах кости мешали определению коэффициента редукции.
4. Обсуждение
Чтобы снизить риск передачи инфекции при аллогенных трансплантации кости, в течение последних 10 лет были опубликованы национальные и международные рекомендации и руководящие принципы [8,17-21]. Было рекомендованы Критерии отбора доноров кости и тестирования доноров на маркеры инфекции. Для повышения безопасности операций по трансплантации были введены процедуры инактивации как тепловой или химической обработкой так и облучением.
Есть несколько причин для широкого применения системы термической обработки Lobator SD-2 для подготовки к трансплантации головки бедренной кости.
Головки бедренных костей могут быть получены из отдельных костей для замены тканей в различных ортопедических и травматологических операциях. Кроме того, патогены, передающиеся костной тканью чувствительны к нагреванию. Термообработка, используемая в системе Lobator может инактивировать патогенных микроорганизмов при сохранении остеоиндуктивности структуры и стабильности кости [10]. Последнее зависит от обработки при нагревании при ≥100 °C (автоклавированием) или пастеризацией [25].
На химические процедуры инактивации влияют недостаточная проницаемость ткани и проблемы в удалении химических веществ из ткани после инактивации [15]. По сообщениям ряда авторов, облучение в значительной степени разрушает остеоиндуктивные свойства трансплантатов, особенно при использовании высоких доз[12].
Термическая обработка головки бедренной кости предыдущей моделью Lobator SD-1, была рассмотрена в деталях [9,22]. Головки бедренных костей разного размера и плотности послужили моделями, который проходили обработку в водяной бане, нагретой до течение 30 мин до 80 °С. Было определено время воздействия (по меньшей мере 10 мин), необходимое для достижения температуры 80 °С в ядре, даже для головок большого размера.
Последние данные по инактивации CLB включая BVDV и парвовирус CPV, привели к предложению увеличить эффективный режим температура/временя до 82,5 С/15 мин).
Мы свидетельствуют, что в системе Lobator SD-2 при необходимых параметрах (82,5 С, 15 мин) достигалась воспроизводимость инактивации различных релевантных и модельных вирусов, в очищенной от хряща головки бедра с диаметром 56 мм. Если диаметр был 60 мм, параметры инактивации не воспроизводились гарантировано.
Как и ожидалось, использование полипропиленовой трубки в вирусной модели, повлияло на пик и продолжительность воздействия максимальных температур и, соответственно, на общее количество тепла в сравнении с производственным условиям. Но во всех головках бедренной кости с диаметром между 51 и 58 мм, требуемый температурный и временной режим был достигнут. Следовательно, подавление активности, выявленное для вирусной модели распространяются не только на производственных условия термической дезинфекции головки бедра, но и представляет собой «наихудший случай».
Приминительно к трансплантации кости, вирус ВИЧ был классифицирован как слабо устойчивый к физикохимической обработке. Известно, что ВИЧ термолабилен и
быстро инактивируется при ≥60 (C [22,26]. Данные о достаточной инактивации ВИЧ системой Lobator sd-1 были опубликованы ранее [22] и подтверждены в настоящем исследовании.
Хорошо известно, что термостойкость вирусов зависит от вида вируса и типы среды (сухой или влажный нагрев, содержание белка) [27]. В суспензионных экспериментов при 65 С в течение 15 мин (Lelie и др.) [28] показана полная инактивация вируса коровьей оспы (Poxviridae), вируса энцефаломиокардита (Picornaviridae), Синдбис вируса (Togaviridae), вируса гепатита В мышей (Coronaviridae), вируса гриппа (Orthomyxoviridae), вируса везикулярного стоматита (Rhabdoviridae) и цитомегаловируса (Herpesviridae). Существенное влияние окружающей среды было продемонстрировано для парвовирусов. Для инактивации BPV в питьевой воде требуется температура 80 °С и время 15 мин, в бидистиллированной воде - 27 мин и 9 мин в среде для культивирования клеток. Виганд и др. [29] показали, что устойчивость к нагреву увеличивается в 3 раза, когда вирус в клеточной культуральной среде разбавляют бидистиллированной водой (1: 100). Под действием сухого тепла при 100 С BPV показывает исключительно
высокую устойчивость. Вирус, суспендированный в плазме показывает более высокую
теплостойкость, чем вирус, взвешенных в бидистиллированной воде [30]. Поэтому непосредственный контакт вирусов с центром исследуемой головки бедренной кости имеет важное значение для валидации процесса инактивации.
HBV and H CV остаются проблематичными вирусами при трансплантации головки бедренной кости (а также при переливании крови и трансплантации органов) [31-33]. Оба вирусы не могут быть использованы in vitro в системах клеточных культур, и только в ограниченной степени в экспериментах на животных [17,32].
По этим причинам BVDV рассматривается как модель для HCV и парвовирусов в качестве высоко термостойких вирусов. В другой модели системы HCV Шарм др. [26] показали, что вирус желтой лихорадки, как представитель Flaviviridae полностью инактивируется при 60 С через 5 мин.
По двум причинам человеческий HBV не может быть использован в исследований системы Lobator sd-2: (1) в настоящее время, нет в целом подходящей системы клеточной культуры, и вирус гепатита В утки (DHBV), который использовали в качестве модели для HBV в других исследованиях [34] растет только в первичных гепатоцитах утки, непригодных для исследования тепловой обработке костной ткани. Кроме того, немецкий Консультативный Комитет Крови заявил, что до сих пор нет подходящей модели вируса человеческого гепатита, и что, следовательно, такие исследования не могут быть проведены [32]. (2) После инактивации в Lobator SD-2, гомогенизируют и центрифугируют суспензию вируса, содержащую остатки жира и костной ткани, которые ингибируют амплификацию нуклеиновых кислот методом ПЦР (ингибиторы, возмущающих факторы). Таким образом, ПЦР не подходит для оценки процедуры инактивации в обычных условиях и может служить лишь в качестве дополнительного критерия оценки эффективности [35].
Есть аргументы в пользу использования парвовирусов как термостойких вирусов в при оценке тепловой дезинфекции [27]. Результаты по Brauniger др. [30] показали, что при 60 С BPV показывает термостойкость по крайней мере, подобную HBV. Поэтому по термостойкости BPV могут быть использованы в качестве модельного
вируса HBV при изучении эффективности тепловой дезинфекции. В наших исследований BPV был полностью инактивирован, т.е. на ≥log10. Borovec и др. [36] рекомендуют PRV в качестве модели для подтверждения инактивации вируса гепатита. Проведенные исследования также показали полную инактивацию PRV, а также достаточное снижение титра. Кроме того, исследованные безоболочечных вирусы (HAV, PV-1) были полностью инактивированы в системе Lobator SD-2 на ≥4log10.
В заключение, мы можем констатировать, что в системе Lobator SD-2 для термической дезинфекции достигается достаточное снижение титра (на 4 log 10) клинически значимых вирусов. Для предупреждения физиологических колебаний морфологии и содержания жира, рекомендуется использовать головку бедренной кости размером 56 мм. Кроме того, должны соблюдаться критерии отбора доноров для костных банков в соответствии с руководящими принципами Немецкой медицинской ассоциации, должны быть произведены необходимые серологические тесты, а также, в случае использования головок бедренных костей от полиорганных доноров, обязательно должны быть проведены дополнительные испытания в отношении генома ВИЧ-инфекции, гепатитов В и гепатита С методами амплификации нуклеиновых кислот (например, ПЦР).
Благодарность
Авторы благодарят Dr Katharina Rokos, Mr Sven Schurig и Mr Frank Schweiger за большую поддержку во время экспериментальной работы.
Ссылки
[1] Jerosch J. Knochenbanken in der BRD. Ergebnisse einer Befragung. Unfallchirurg 1990;93:334–8.
[2] von Garrel T, Gotzen L. Allogeneic bone transplantation and bone banking. Unfallchirurg 1998;101:713–27.
[3] Kakaiya R, Miller WV, Gudino M. Tissue transplant-transmitted infections. Transfusion 1991;31(3):277–84.
[4] Wilmes E, Gu ̈rtler L, Wolow H. Zur U ̈ bertragung von HIV-Infektionen durch allogene Transplantate. Laryngol Rhinol Otol 1987;66:332–4.
[5] Habal MB, Reddi AH. Bone grafts and bone substitutes. Philadelphia: W.B. Saunders, 1992.
[6] CDC. Transmission of HIV through bone transplantation: case report and public health recommendation. MMWR 1988; 37:597–9.
[7] EMEA/CPMP. Note for guidance on minimising the risk of transmitting animal spongiform encephalopathy agents via human and veterinary medicinal products. EMEA/410/01 rev 1, London; 31 May 2001.
[8] Wissenschaftlicher Beirat der Bundesa ̈rztekammer. Richtlinien zum Fu ̈hren einer Knochenbank. Dtsch A ̈ rzteblatt 2001;98(15): A1011.
[9] Hofmann C, Garrel T, von Gotzen L. Knochenbankmanagement bei Verwendung eines thermischen Desinfektionssystems (Lobator SD-1). Unfallchirurg 1996;99:498–508.
[10] Knaepler H, von Garrel T, Gotzen L. Untersuchungen zur Desinfektion und Sterilisation allogener Knochentransplantate. Hefte Z Unfallchir 1994;235:1–101.
[11] Smith RA, Ingels J, Lochemes JJ, Dutkowsky JP, Pifer LL. Gamma irradiation of HIV-1. J Orthop Res 2001;19:815–9.
[12] Pruss A, Kao M, Gohs U, Koscielny JK, von Versen R, Pauli G. Effect of gamma irradiation on human cortical bone transplants contaminated with enveloped and non-enveloped viruses. Biologicals 2002;30(2):125–33.
[13] Pruss A, Kao M, Kiesewetter H, von Versen R, Pauli G. Virus safety of avital bone tissue transplants: evaluation of sterilization steps of spongiosa cuboids using a peracetic acid–methanol mixture. Biologicals 1999;27:195–201.
[14] von Versen R, Heider H, Kleemann I, Starke R. Chemische Sterilisation biologischer Implantate mit einer Kombinations-methode. In: Pesch H-J, Sto ̈ß H, Kummer B, editors. Osteologie aktuell. Philadelphia: Bern, 1992;vol. 2 (Suppl):380–6.
[15] Pruss A, Baumann B, Seibold M, Kao M, Tintelnot K, von Versen R et al. Validation of the sterilization procedure of allogeneic avital bone transplants using peracetic acid–ethanol. Biologicals 2001;29:59–66.
[16] Munting E, Wilmart JF, Wijne A, Hennebert P, Delloye C. Effect of sterilization on osteoinduction. Comparison of five methods in demineralized rat bone. Acta Orthop Scand 1988;59(1):34–8.
[17] Bekanntmachung des Paul-Ehrlich-Institutes und des Bundesinstitutes fu ̈r Arzneimittel und Medizinprodukte. Anforderungen an Validierungsstudien zum Nachweis der Virussicherheit von Arzneimitteln aus menschlichem Blut oder Plasma. Bundesanzeiger vom. vol. 84; (04.05.1994). p. 4742–4.
[18] Europa ̈ische Norm EN 1040. Chemische Desinfektionsmittel und Antiseptika, Bakterizide Wirkung (Basistest) Pru ̈fverfahren und Anforderungen. Bru ̈ssel: CEN (Europa ̈isches Komitee fu ̈r Normung); 1997.
[19] CPMP. Note for guidance on virus validation studies: the design, contribution and interpretation of studies validating the inactivation and removal of viruses. CPMP/BWP/268/95, final version. London; February 29, 1996.
[20] CEN. Sterilization of medical devices utilizing tissues—validation of the inactivation of viruses and other transmissible agents. 316/WG3/N-02; July 20, 1994.
[21] Bundesinstitut fu ̈r Arzneimittel und Medizinprodukte. Bekanntmachung zu allogenen Gewebetransplantaten. Bundesanzeiger 1996;75:4670.
[22] von Garrel T, Knaepler H, Gu ̈rtler L. Untersuchungen zur Inaktivierung von HIV-1 in humanen Femurko ̈pfen durch Verwendung eines thermischen Desinfektionssystems Lobator SD-1. Unfallchirurg 1997;100:375–81.
[23] Scheidler A, Rokos K, Reuter T, Ebermann R, Pauli G. Inactivation of viruses by beta-propiolactone in human cryo-poor plasma and IgG concentrates. Biologicals 1998;26:135–44.
[24] Spearman A, Ka ̈rber G. Cavalli-Sforza L, editor. Biometrie. Grundzu ̈ge biologisch-medizinischer Statistik. Stuttgart: Gustav Fischer, 1974;171–3.
[25] Herr G, Schmid U, Holz G, Reutter K, Schnettler R. Einfluss verschiedener Desinfektions- und Sterilisationsverfahren auf die biologische Aktivita ̈t und Struktur von Knochengewebe. In: Schnettler R, Markgraf E, editors. Knochenersatzmaterialien und Wachstumsfaktoren. Stuttgart: Georg Thieme, 1997;84–7.
[26] Charm E, Landau S, Williams B, Horowitz B, Prince AM, Pascual D. High-temperature short-time heat inactivation of HIV and other viruses in human blood plasma. Vox Sang 1992; 62:12–20.
[27] Bra ̈uniger S, Peters J, Borchers U, Kao M. Further studies on thermal resistance of bovine parvovirus against moist and dry heat. Int J Hyg Environ Health 2000;203(1):71–5.
[28] Lelie PN, Reesink HW, Lucas CJ. Inactivation of 12 viruses by heating steps applied during manufacture of a hepatitis B vaccine. J Med Virol 1987;23:297–301.
[29] Wigand R, Bachmann M, Brandner G. Stabilization of isomeric DNA viruses against thermoinactivation by lowered ionic strength. Arch Virol 1981;69:61–9.
[31] Bra ̈uniger S, Fischer I, Peters J. Zur Temperaturstabilita ̈t des bovinen Parvovirus. Zbl Hyg 1994;196:270–8.
[32] Roggendorf M. Bedeutung der HCV-Infektion fu ̈r die Posttransfusionelle Hepatitis (Significance of HCV infection for posttransfusion hepatitis). Infus Ther Transfus Med 1994;1(Suppl):12–8.
[33] Burger R, Gerlich W, Gu ̈rtler L, Heiden M, Hitzler W, Jansen B et al. Hepatitis B virus. Infus Ther Transfus Med 2000;27:226–34.
[34] Eggen BM, Nordbo SA. Transmission of HCV by organ transplantation. N Engl J Med 1992;326(6) discussion 412–3.
[35] Murray SM, Freiman JS, Vickery K, Lim D, Cossart YE, Whiteley RK. Duck hepatitis B virus; a model to assess efficacy of disinfectants against hepadnavirus infectivity. Epidemiol Infect 1991;106:435–43.
[36] Willkommen H. Erfahrungen mit der Praxis von Infektionsassays und Modellviren fu ̈r die Beurteilung der Sicherheit von Blutprodukten fu ̈r den Patienten. In: Rabenau HF, Thraenhart O, Doerr HW, editors. Nosokomiale Virusinfektion—Erkennung und Beka ̈mpfung. Lengerich: Pabst Science Publishers, 2001; 166–73.
[37] Borovec S, Proumis C, Adcock W, Fang R, Uren E. Inactivation kinetics of model and relevant blood-borne viruses by treatment with sodium hydroxide and heat. Biologicals 1998;26(3):237–44.
