Обеспечить биологическую безопасность костной ткани - вызов для специалистов в сфере ортопедии и травматологи. Будучи допущенным фармацевтическим препаратом, "человеческая головка бедра, прошедшая термическую дезинфекцию, консервирование глубоким охлаждением (замораживанием), производственная линия CHB" в Австрии подпадает под действие Закона о безопасности тканевых препаратов (GSG). На вопросы об изготовлении, хранении и дистрибуции человеческих головок бедра нам ответил специалист в области трансфузионной медицины приват-доцент, доктор Аксель Прус из банка донорской ткани клиники Шарите в Берлине, одного из учреждений в Европе, авторизованных в области тканевых препаратов.
 |
А. Прус, Берлин: "В рамках 9-12-месячного процесса реконструкции (ремоделлинга) человеческая головка бедра преобразуется в максимальной степени в аутогенную ткань. В случае имплантации искусственного материала заменителя костной ткани это невозможно". |
В чем заключается разница между тканями, произведенными из материала из местного банка костной ткани, и допущенным фармацевтическим препаратом "человеческая головка бедра"?
А. Прус: Разница, собственно говоря, между обоими препаратами тканей не существенна, так как в обоих случаях обеспечивается соблюдение норм инструкций по выполнению стандартизированных операций по подбору донора, тестированию и термической дезинфекции. Разница заключается, прежде всего, в том, что "человеческая головка бедра, прошедшая термическую дезинфекцию, консервирование глубоким охлаждением (замораживанием)", разрешенная к применению согласно §21a Закона об обращении лекарственных средств должна сопровождаться нанесением этикеток в соответствии с официально утвержденной процедурой, а также иметь сопроводительную документацию, чтобы быть запущенной в оборот для реализации.
Как Вы оцениваете ситуацию с местными банками костной ткани?
А. Прус: Ситуация в Германии лучше, чем предполагалось до вступления в силу закона о тканевых препаратах 01.08.2007. Если тогда исходили из того, что количество локальных банков костной ткани, т.е. расположенных в больницах, будет резко сокращаться, то сегодня следует констатировать, что около двух третей немецких банков костной ткани получили разрешения в соответствии с §20b и §20c Закона об обращении лекарственных средств. Наряду с активным участием профессионального сообщества и экспертных групп, прежде всего, хорошим подспорьем в данном случае оказалось разъяснение понятия "запуск в оборот", которое дало Федеральное министерство здравоохранения. В соответствии с этим разъяснением банку костной ткани не нужно получать разрешение от федерального органа государственного управления в соответствии с §21a Закона об обращении лекарственных средств, если головка бедра остается в распоряжении подразделения. Благодаря этому значительно снизился объем подаваемых заявок.
Университетский банк донорской ткани при клинике Шарите в Берлине является базовым учреждением для Марбургской системы банков костной ткани по термической дезинфекции человеческих головок бедра от живых доноров. Что означает термин "термическая дезинфекция"?
А. Прус: Включение процесса термической дезинфекции в процедуру изготовления аллогенных человеческих головок бедра для целей трансплантации служит исключительно для того, чтобы обеспечить повышение уровня биологической безопасности ткани. Это удается осуществить за счет уменьшения количества, т.е. эффективного и действенного обеднения среды возбудителей вирусных и невирусных заболеваний. Для этого после удаления хряща головка бедра в растворе Рингера подвергается нагреву в соответствии с заданными параметрами. В ходе этого процесса нагрева гарантированно обеспечивается температура 82,5°C в сердцевине головки в течение, как минимум, 15 минут. Система отлично и эффективно осуществляет инактивацию клинически значимых вирусов, а также бактерий и грибков. Это тем более важно, если учитывать тот факт, что более 10% изъятых головок бедра имеют бактериально контаминированную поверхность. При этом, несмотря на термическое воздействие на ткань, удается соответствовать клиническим требованиям к заменителю костной ткани.
Насколько надежно термическая дезинфекция обеспечивает защиту от переноса возбудителей СПИД, гепатита, бактерий? Какие проводятся тесты?
А. Прус: Метод прошел многократную валидацию применительно к защите от клинически релевантных вирусов или их "модельных вирусов" (model viruses). Отчеты исследований опубликованы, они прошли глубокую проверку и получили достаточную оценку немецкого федерального ведомства, Института Пауля Эрлиха. Сертификата качества более высокого чем этот едва ли можно добиться. Также в таком же формате было проведено исследование по инактивации бактерий и грибков, и был получен положительный ответ. Споры или спорообразующие бактерии могут быть инактивированы ограниченно в связи с температурами, применяемыми в ходе этого метода. Однако это имеет второстепенное значение с учетом концепции безопасности банков костной ткани (анамнез, клиника, тестирование, стерильное взятие в ходе операции, контроль на стерильность).
Согласно предписаниям Распоряжения о требованиях к качеству и безопасности при взятии тканей и их пересадке в соответствии с положениями Закона о трансплантации (TPG-GewV), а также в соответствии с положениями Директивы Федеральной ассоциации врачей в настоящее время проводится тестирование донора на антитела СПИД, антитела HGV (гепатит G), антитела HBc (гепатит B), HBsAg (гепатит B, австралийский антиген) и TPHA (реакция пассивной гемагглютинации, сифилис). На этапе конечного продукта производится контроль на стерильность в соответствии с требованиями Европейской фармакопеи (ЕФ).
Какие доноры рассматриваются при этом? Есть ли ограничения по возрасту?
А. Прус: Доноры проходят тщательное обследование и должны заполнить подробную анкету, составленную
на основе анкеты службы донорской крови. Целью является исключение из донорства пациентов, имеющих риски наличия инфекции и заболеваний, которые могут ограничить и снизить биологическое качество ткани. Пациент, конечно, должен дать согласие на донорство и на тестирование. В настоящее время возраст еще ограничен 76 годами, но запланировано повышение возраста.
По каким показаниям пригодна пересадка головки бедра в качестве аллогенного трансплантата? Могут ли быть обработаны все размеры дефектов с его помощью?
А. Прус: Основным показанием является замена костной ткани в рамках ревизионных повторных операций в эндопротезировании. Но и в случае операций на костях конечностей или позвоночнике, при которых необходимо заменить утраченную костную ткань, также используется костная губчатая ткань, прошедшая термическую дезинфекцию. В какой степень головка бедра пригодна для компенсации индивидуальных дефектов - это должен решить ортопед или врач-травматолог в каждом отдельном случае, однако могут быть использованы и несколько трансплантатов головки бедра.
Какова продолжительность процесса?
А. Прус: После удаления хряща и помещения в контейнер для термической дезинфекции добавляется определенное количество раствора Рингера. Запечатанный дезинфекционный контейнер помещается в аппарат Lobator-sd-2, и запускается процесс дезинфекции. Его продолжительность 94 минуты, и это время невозможно изменить. По завершении процесса выдается распечатка с последовательным листингом процесса.
Каким образом фармацевтический препарат "головка бедра" доставляется в больницу? При каких условиях осуществляется хранение головки бедра в больнице?
А. Прус: Перевозка головки бедра в состоянии глубокого охлаждения осуществляется под контролем при температуре ≤-18°C. Хранение осуществляется при температуре ≤-35°C в течение максимум 2 лет. Если хранение препарата осуществляется при температуре менее -70°C, то возможен максимальный срок хранения 5 лет.
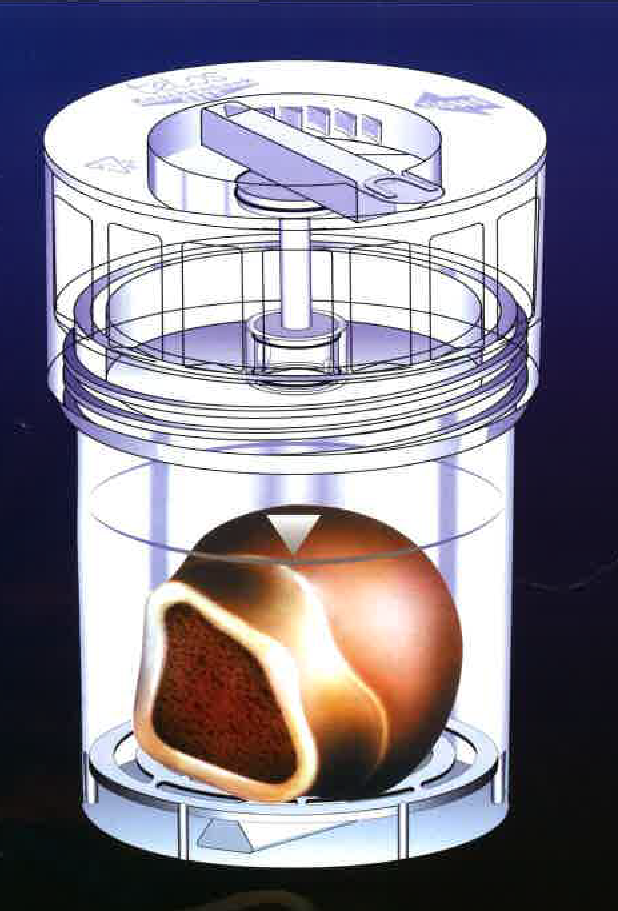
|
Фармацевтический препарат
человеческая головка бедра
Человеческая головка бедра проходит термическую дезинфекцию, а затем консервирование глубоким охлаждением (замораживанием) в банке донорской ткани при клинике Шарите на основе зарекомендовавшей себя и утвержденной в соответствии с требованиями Марбургской системы банков костной ткани.
При этом применяются исключительно головки бедра от живого донора из Германии.
Марбургская система банков костной ткани, включая систему управления качеством (SOPs) также находится в распоряжении и локальных банков костной ткани.
Более чем 170000 операций по имплантированию во всем мире являются подтверждением безопасности и качества.
medworx Vertriebs GmbH • Ластенштрассе, 22 • 5020 Зальцбург • +43 662 / 908002 • www.medworx.at
medworx Deutschland Vertriebs GmbH • Глинкаштрассе, 32 • 10117 Берлин • Бисмаркштрассе, 18 • 35037 Марбург *
* Дистрибуция фармацевтического препарата "человеческая головка бедра" осуществляется компанией Deutschland Vertriebs GmbH.
|
Имеется ли литература по этой методике?
А. Прус: Да. С очень большим собранием микробиологических и клинических работ по термической дезинфекции можно ознакомиться на интернет-странице разработчика системы (www.telos-marburg.de).
Как Вы оцениваете приживляемость костной ткани?
А. Прус: Ткань по типу "барьера" в максимально возможной степени преобразуется в собственную, аутогенную ткань в рамках процесса реконструкции (ремоделлинга) в течение периода от 9 до 12 месяцев. В случае имплантации искусственного материала заменителя костной ткани это невозможно".
Насколько современна эта система, по Вашему мнению?
А. Прус: Это простой, но эффективный метод для обеспечения биологической безопасности костной ткани. Здесь не стоит вопрос о современности метода. Сравните все это с определением группы крови по системе ABO. Методику определения группы крови на плоскости предложил Карл Ландштайнер еще в 1900 году. Однако эта методика с усовершенствованиями в отношении тестируемых сывороток крови до сих пор базируется на простой реакции антиген-антитело.
Имеется ли разрешение на применение головки бедра в Австрии?
А. Прус: "Человеческая головка бедра, прошедшая термическую дезинфекцию, консервирование глубоким охлаждением (замораживанием), производственная линия CHB" является фармацевтическим препаратом, подпадающим в Австрии под действие Закона о безопасности тканевых препаратов (GSG). Поэтому препарат должен быть изготовлен, проходить хранение и дистрибуцию в учреждении по работе с тканями, имеющим допуск для этого в Европе. Так как в распоряжении банка донорской ткани клиники Шарите имеются соответствующие требуемые разрешения в соответствии с §13 Закона об обращении лекарственных средств или §21, §105 Закона об обращении лекарственных средств, то круг замыкается. Австрийским Законом о безопасности тканей также предусмотрено, что хранение и дистрибуция тканей могут осуществляться лишь только учреждениями, авторизованными в области работы с тканевыми препаратами. Под "хранением" в соответствии с положениями Закона о безопасности тканей (§2 п.9 GSG) подразумевается хранение продукта в учреждении вплоть до момента дистрибуции. В случае импорта из Германии продукт передается из банка донорской ткани (например, клиники Шарите) в австрийскую больницу, и, тем самым, считается уже прошедшим этап дистрибуции. В связи с этим дальнейшие "манипуляции или хранение" в больнице вплоть до момента применения более не подпадают под определение "хранения" в соответствии с положениями Закона о безопасности тканей.
Благодарим Вас за интервью!
Нам дал интервью:
приват-доцент, доктор Аксель Прус
Институт трансфузионной медицины
Университетская клиника Шарите, Берлин
Шаритеплатц, 1, 10117 Берлин
Тел.: 0049/30/450 52 51 61, -126
Местн. 090546
Терапия хронических болей
Новый фентаниловый пластырь со специальной матрицей
С 1 октября в продаже Matrifen®, трансдермальный матричный пластырь для обезболивания при наличии болей средней силы и вплоть до сильных хронических болей. Пластырь содержит активное вещество фентанил в растворенной форме (капли дипропиленгликоль), заключенное в силиконовую матричную подложку. Особая схема обеспечивает высокую степень использования активного вещества: Содержащееся в пластыре количество активного вещества и размер самого пластыря могут быть уменьшены без негативных последствий для выделения активного вещества из пластыря и для фармакокинетических свойств пластыря. Внешняя защитная пленка изготовлена из прозрачного, инертного и окклюзионного слоя полиэстера с силиконовым покрытием, защищающего системы выделения активного вещества пластыря. Силиконовая матрица предупреждает свободное вытекание фентанила и, тем самым, передозировку. Обеспечивающая дозированную подачу активного вещества диффузионно-контрольная мембрана, расположенная под матрицей активного вещества (сополимер этилена и винилацетата) обеспечивает постоянную подачу активного вещества в течение 72 часов (6 суток).

Облегчение и контроль болей, профиль безопасности и уровень качества жизни соответствуют показателям при использовании препарата Дюрогезик (Durogesic) и оральных опиоидов.1 Биоэквивалентность (фармакокинетическая эквивалентность) матрифена дюрогезику подтверждена научными исследованиями.2 В распоряжении имеется матрифен с эффективностью действия 12, 25, 50, 75, 100 мкг/ч.
1 Kress HG, Von der Laage D, Hoerauf KH et al: A randomised, open, parallel-group, multi-center trial to investigate analgesic efficacy and safety of a transdermal fentanyl patch compared to Standard Opioid treatment in Cancer pain Journal of Pain and Symptom Management 2008; 36 (3):
268-279
2 Marier JF, Lor M, Morin J et al: Comparative bioequivalence study between a novel matrix transdermal delivery System of fentanyl and a commercially available reservoir formulation Br Clin Pharmacol 2007; 63(1):121-4
Источник: Официальное сообщение Грюненталь (Grünenthal) для СМИ
